多発性硬化症の診断や治療に関する最新の情報サイト
専門医田中正美のホームページ
電話でのご予約・お問い合わせはTEL.075-822-2777
患者さま向け
多発性硬化症(MS)とはどのような病気でしょうか
赤の文字は2016年2月24日に修正・追加した情報です。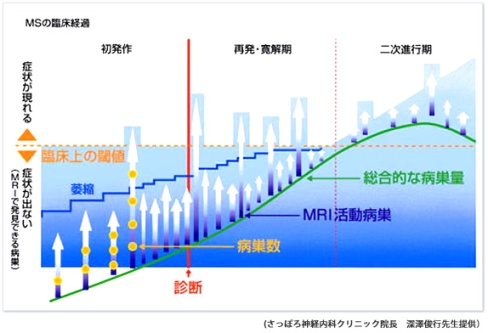
MSの臨床経過。初めて症状が出現する時期初発時よりもっと早く、病変は起きています。また、脳MRIで見ると再発の数倍も新しい病変が出現しており(再発は氷山の一角)、一部の患者さんは二次進行性の経過を取ることもあり、このときに再発が上乗せすることもあります。軸索変性は病初期から始まっていて、放っておきますと、じわっと病気が進行してゆきます。早期診断と早期治療が大切な理由です。
田中正美:多発性硬化症の疫学-古典的常識の修正と最近の話題-。神経内科, 62(1):90-9, 2005.
田中正美、田中恵子:多発性硬化症の治療。日内会誌 2013;102:1971-7.
田中正美:多発性硬化症の発症リスクとしての環境因子-ビタミンD、Epstein-Barrウイルス、喫煙歴に関する最近の疫学研究の進歩- 神経内科
2013;79:275-84.
田中正美: 多発性硬化症、視神経脊髄炎の診断と治療。神経治療 2014;31:127-9.
田中正美. 多発性硬化症の特徴と治療・看護。臨床老年看護 2014;21(5):12-20.
脳に病巣のある古典型は戦前の日本人にはありませんでした
1950年から患者さんの報告が始まり、最初に病理学的に証明された患者さんの報告は1964年です。昔は、MRIがなかったため、多発性硬化症の診断は難しく、確実に診断するには病理学的に調べないとできませんでした。
患者数(有病率)は増加傾向
日本人ではそもそも患者数が少ないのですが、古典型が増加傾向にあります。1972年の調査では、10万人に0.8-4人でしたが、2000年の京都での調査では、7-10人と増加しています。
欧米白人では10万人に60-200人。世界的にも増加傾向があり、発見率・診断率の上昇のみでなく、真に増加しています。その理由は、女性患者が特に増
加しているからです。神経内科医の増加やMRIの普及だけでは、世界中で認められるこの性差は説明できません。
女:男 = 2.3:1
発症の原因・・・体質と感染、環境の組み合わせについて
- 環境因子が原因の65%を占めています。
- 感染因子(ヘルペス属などウイルスや細菌?)が発症の引き金になっています。
・緯度=太陽光(=ビタミンDが発症を抑制? 赤道に近い地域は少ないことが判っています。
・食品では長鎖飽和脂肪酸(魚油)が発症を抑制。
- 遺伝的体質が原因の35%(1 卵生双生児で一人がMSの時にもう一人もMSとなる可能性が高いことが判っています。)があり、少なくとも20の発病させ易くする遺伝子(疾患感受性遺伝子)の組み合わせで決まりますので、家族でも全く同じ体質をもつ人は稀です。欧米人では家族内発症が約10%、日本人では家族発症はまれであり、遺伝病ではありません。
発病の再発やきっかけ
発病しやすい体質を持つ人に、何かの感染が引き金となり、免疫のバランスが崩れて、髄鞘に対する自己免疫による攻撃が始まります。ストレスが発症を促進することがあります。
中枢神経の主に白質に多発する脱髄病変が反復して生じる
中枢神経系(脳、脊髄、視神経)の白質(神経繊維の髄鞘の多いところ)、髄鞘が主に攻撃され破壊されています。 髄鞘とは、乏突起神経膠細胞(オリゴデンドログリア、oligodendroglia)の突起が神経細胞の主要な突起である長い軸策をぐるぐると
10−50回も取り巻き、ついで乏突起神経膠細胞の細胞膜のみがくっついて重なり合い厚い膜を形成してできたものを髄鞘とよびます。
・脱髄病変とはどのような病変か−病変の出来方は多様で個人差が大きいー
小静脈周囲にTリンパ球、食細胞(マクロファージ)が浸潤し、Bリンパ球が分泌する抗体(IgG)が続いて侵入することが多く、免疫学的破壊を行います。
・脱髄病巣=主に髄鞘(ミエリン)が破壊されますが、神経細胞の軸索も傷害されることが最近判ってきました。小さな病巣から、巨大病巣まで色々の大きさのものが生じます。
神経細胞・軸索の破壊で回復しない障害を生じ、脳や脊髄の萎縮を生じます。
神経細胞・軸索の破壊も生じ、これが障害固定化の原因であるので重要です。
神経細胞・軸索の発病初期からの破壊・変性が、従来考えられていた以上に存在し、神経細胞は再生、修復能力が少ないため、次第に障害が蓄積します。
機能の低下、障害の蓄積、進行には、神経細胞・軸索の破壊からの防御が最も重要で、治療の最重要課題と考えます。
自己免疫疾患である可能性が高い
正常では生じない自分自身の細胞の抗原物質(蛋白)に対する免疫(=自己免疫)が生じ、自己の組織に対する、間違った攻撃、破壊を仕掛けます。免疫はリンパ球が主役でT細胞とB細胞(抗体=IgG, IgA, IgM等を分泌する)よりなりますが、他に食細胞(マクロファージ)等もあります。
病型により経過に違いがある
<進行モードによる分類>
- 寛解再発型MS(RRMS)85% 再発増悪の間の期間には進行しません。
- 二次進行型MS(SPMS) 8.6% 初期に再発型であった後、1年以上の連続的進行を示します。
- 一次進行型MS(PPMS) 6% 発症時より持続的な進行を示します。 (PPMS、SPMSでは急性 増悪と改善が重なっても、一ヶ月以内に再び慢性進行期に戻りま す。)
※上記の%は日本人のデータではありません。公式のデータはありませんが、少なくともPPMSの頻度はもっと少ないと専門医たちは感じています。
2015年に難病新法が施行され、新しい難病政策の下、従来の視神経脊髄炎も含めた、広義の行政用語と しての「多発性硬化症」ではなく、申請用紙は同じですが、視神経脊髄炎と欧米で言う多発性硬化症と、 診断が異なることが判るようになりました。
- 視神経脊髄炎(欧米ではNeuromyelitis opticaと呼んでいます。再発しないタイプを特にデービック病と呼びます。) 33%。
視神経と脊髄が比較的選択的に障害されますが、大脳にも病変が出現します。最近、世界中で話題になっています。この病型の特徴は、脊髄MRIで脊髄中心部 に連続した3椎体以上に及ぶ長い脊髄病変が認められたり(3椎体以下でも、脊髄中央部に病変がある場合は、NMOが疑わしいです)、血液中にアクアポリン4に対する抗体(抗アクアポリン4抗体)が認められたりします。アクアポリ ン4は水分子を通過させる機能があって細胞の表面に存在します。これが重要と考えられている理由は、アクアポリン4がアストログリアという血液脳関門とい う中枢神経(視神経、脳、脊髄)を守る機能を司っていることで、これが傷害されることで、血液脳関門が破壊されて、造影剤で造影される病変が形成された り、より強い傷害が起きる可能性があります。この病型では、アクアポリン4の豊富な脳室という頭蓋内で脊髄液がたまっている場所の周辺や、やはり脊髄の中心管という脊髄液のある周辺に病変ができやすい、という特徴があります。 - いわゆる古典型 MS(欧米でいうMS)67% 大脳・小脳にも病変を有します。
日本人の多発性硬化症は白人に比べて慢性進行型が少なく、白人では当初80%が再発寛解型で少なくとも半数以上が二次性慢性進行型へ移行すると言われていました。白人の古典型MSが1950年頃から日本人にも出現し増加しつつあります。 - 抗MOG抗体症候群(これは私の主張で、抗リン脂質抗体症候群を念頭に置いています)あるいは抗MOG抗体関連疾患と呼ぶヒトもいます。一時は抗AQP4抗体が陰性のNMO (seronegative NMO) の新しい指標ではないか、と主張する研究者もいましたが、NMOの臨床病型はむしろ稀で、最初に注目されたのは小児の急性播種性脳脊髄炎 (ADEM) や小児期発症MS、成人発症では視神経炎や脊髄炎など臨床病型が多様なので、seronegative NMOの新しいバイオマーカーでNMOの診断に利用できるというのは、早とちりだということが明らかになりました。
多発性硬化症(MS)は主として無症状に進行する病気
新MRI病巣の1−2割しか症状を出しません(軽い間は見逃されている)。さらに、MRIで正常に見える部分でも、過半数の患者さんで、通常のMRIでは検出し得ない病気の活動が慢性的に進行し、病変が出没している可能性があります。早期診断・早期治療の重要性がここにあります。
脳の萎縮の重大性が最近注目
MRIで正常に見える脳の組織でも神経細胞の障害が慢性的に進行していることが多い、と脳スペクトロスコピー法や病理での研究で言われています。
年1回以上の臨床再発の有った患者さんで、平均年4%の萎縮の進行があったという報告もあります。